

人类基因组庞大且复杂,DNA突变、染色体异位、染色体重复、转座子插入等基因组序列异常会引起不同类型的疾病。小鼠模型可以帮助我们解析人类疾病的致病机理,但往往由于两物种基因组在进化上的差异造成解析偏差。如何利用小鼠精确地模拟人类疾病发病过程对于治疗指导和药物开发至关重要。传统的人源化小鼠基于转基因技术,忽略了基因表达的位置和剂量效应,且删除了庞大的内含子序列,无法产生可变剪切后的多种转录单元,导致以偏概全。更重要的是由于受到基因组编辑技术的限制,人们很难将具有远程调控功能的增强子一并人源化,最终也会导致人源化基因的调控和生理条件下的偏差。
近日纽约大学医学院Jef Boeke实验室在Nature发表长文,报道小鼠基因组大片段高效编辑技术,首次实现双等位基因同时大片段编写。文章利用该技术在小鼠胚胎干细胞(mESC)中对新冠受体ACE2全基因进行人源化,并构建出在感染SARS-CoV-2后和人具有高度相似表型的小鼠模型。在随后开发双等位基因编辑技术的过程中,作者首次建立了ACE2受体和TMPRSS2细胞表面丝氨酸蛋白酶2同时大片段人源化的小鼠模型,对于研究长新冠(Long-COVID)以及快速应对突发因冠状病毒引起的疫情提供了宝贵的实验资源。更重要的是,该工作为未来基因组–编写(GP-Write)计划开辟了技术路线。

人工设计基因组序列,并最终合成具有生命特征的生命体能够帮助我们更好地理解基因组工作原理,其产物也可以在方方面面为人类生活提供便利。近二十年来,人们先后对于原核生物和单细胞真核生物的基因组实现了人工设计于合成,但是对于更庞大、更复杂的哺乳动物基因组尚没有可以被广泛应用的技术手段。而哺乳动物作为重要的实验模型,往往更多的被应用在临床研究前期的机理探究和药物筛选中。如果不能高效地编写哺乳动物基因组,我们提升健康水平的能力将大大受限。Jef Boeke实验室早在酵母基因组项目(Sc2.0 project)中就发挥了引领作用,是资深的基因组编写专家。近期他们将基因组多步迭代替换的思路应用到小鼠胚胎干细胞中,设计了哺乳动物大片段改写的方案(图一),mSwAP-In (mammalian Switching Antibiotic markers Progressively for Integration) 。作者首先以小鼠p53基因位点为例,在不改变p53蛋白序列的前提下对癌症高频突变位点(mutationhotspots) 进行重新编码,目的是降低因水解以及其他外源压力对甲基化CpG位点造成的高频突变。作者证明mSwAP-In可以在mESC中高效的改写Trp53序列。随后作者通过Amplicon-Seq证明含有重编Trp53序列的mESC在连续传代近4个月之后,其癌症高频突变位点突变率显著降低。接下来为了证明mSwAP-In可以进行多轮迭代编辑,作者对Trp53下游最长115 kb区域进行改写,通过引入水印(watermarks)序列,发现高于40%的克隆含有插入的水印序列。最终作者通过CRISPR-Cas9或PiggyBAC-excision方法将留在基因组中的筛选基因移除,实现无痕编辑。
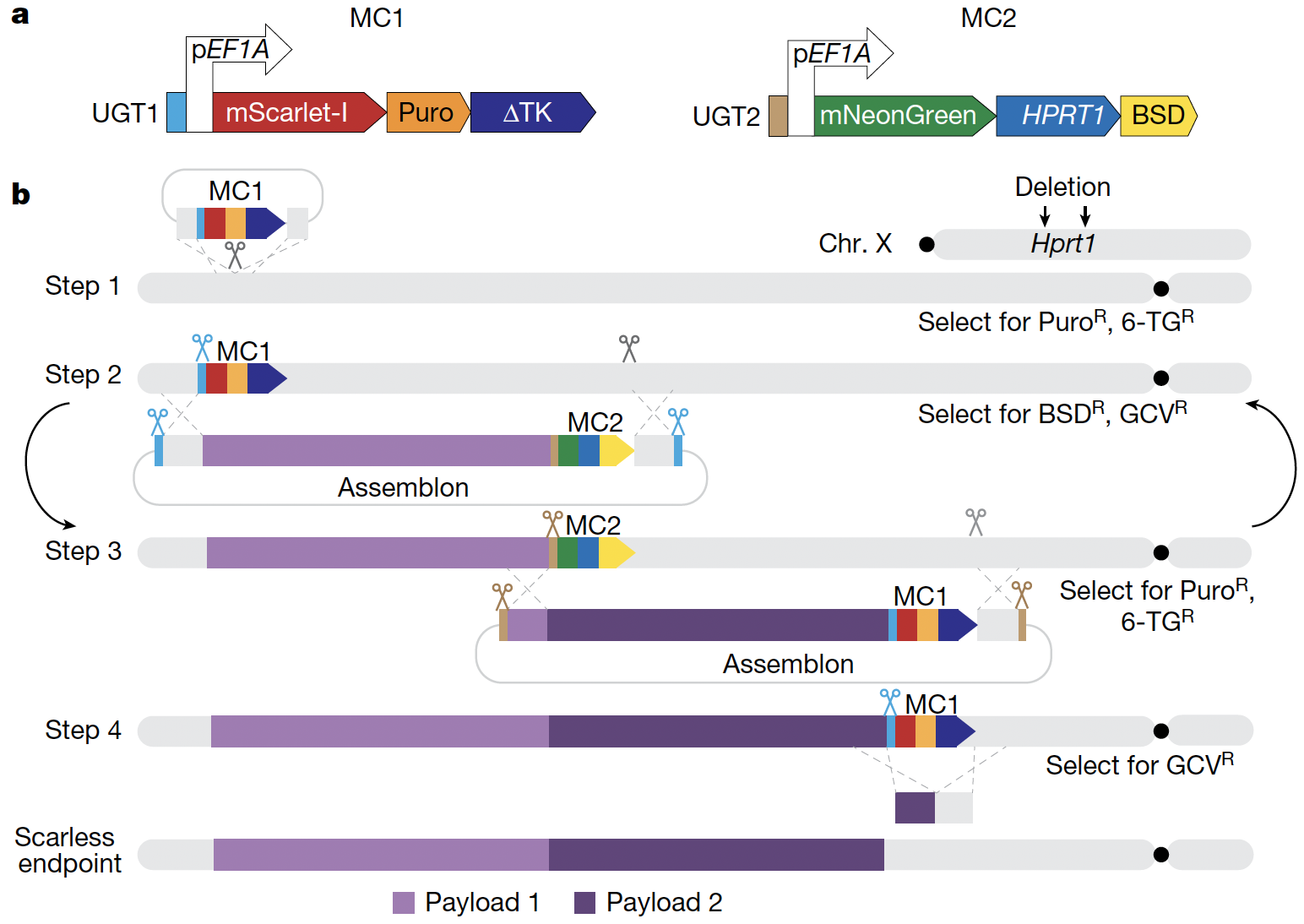
图一,哺乳动物基因组编写策略
接下来作者尝试利用mSwAP-In对小鼠胚胎干细胞进行新冠病毒受体ACE2大片段人源化编写。为了尽量多的保有ACE2基因在内源状态下的时空调控,作者选取了大量有可能包含启动子和增强子的基因间序列以及全部内含子序列,总长度为116 kb 或 180 kb。作者利用酵母作为工具,分别将ACE2全长基因克隆到mSwAP-In递送载体上,最终精准替换了小鼠Ace2基因区域。将ACE2人源化的小鼠胚胎干细胞培育成成年小鼠之后,正如作者所预期的,人源ACE2的时空表达谱在小鼠的体内得到了很好的重现。例如野生型小鼠原本并不像人类一样在睾丸中表达ACE2蛋白,但是经过人源化后的小鼠在睾丸中高水平表达ACE2蛋白。另外,因为作者保留了所有内含子序列,人源ACE2基因在小鼠体内可以被很好地可变剪切,产生了多种人特意性转录单元,有的甚至参与机体干扰素响应过程。最后,作者通过ATAC-Seq实验证明ACE2基因区域在小鼠中也同时保留了原有的可及性。
那么具有表达水平更贴近生理水平的人源化ACE2小鼠是否可以被新冠病毒感染呢?作者和传统转基因小鼠模型K18-hACE2做了SARS-CoV-2感染实验对比,发现K18-hACE2小鼠在感染之后的6-8天之内体重剧烈下降并最终全部死亡。而本文构建的ACE2人源化小鼠全部存活,并在血液样本中检测到中和抗体(图二)。正如绝大多数人类感染新冠病毒之后能够通过体液反应恢复。
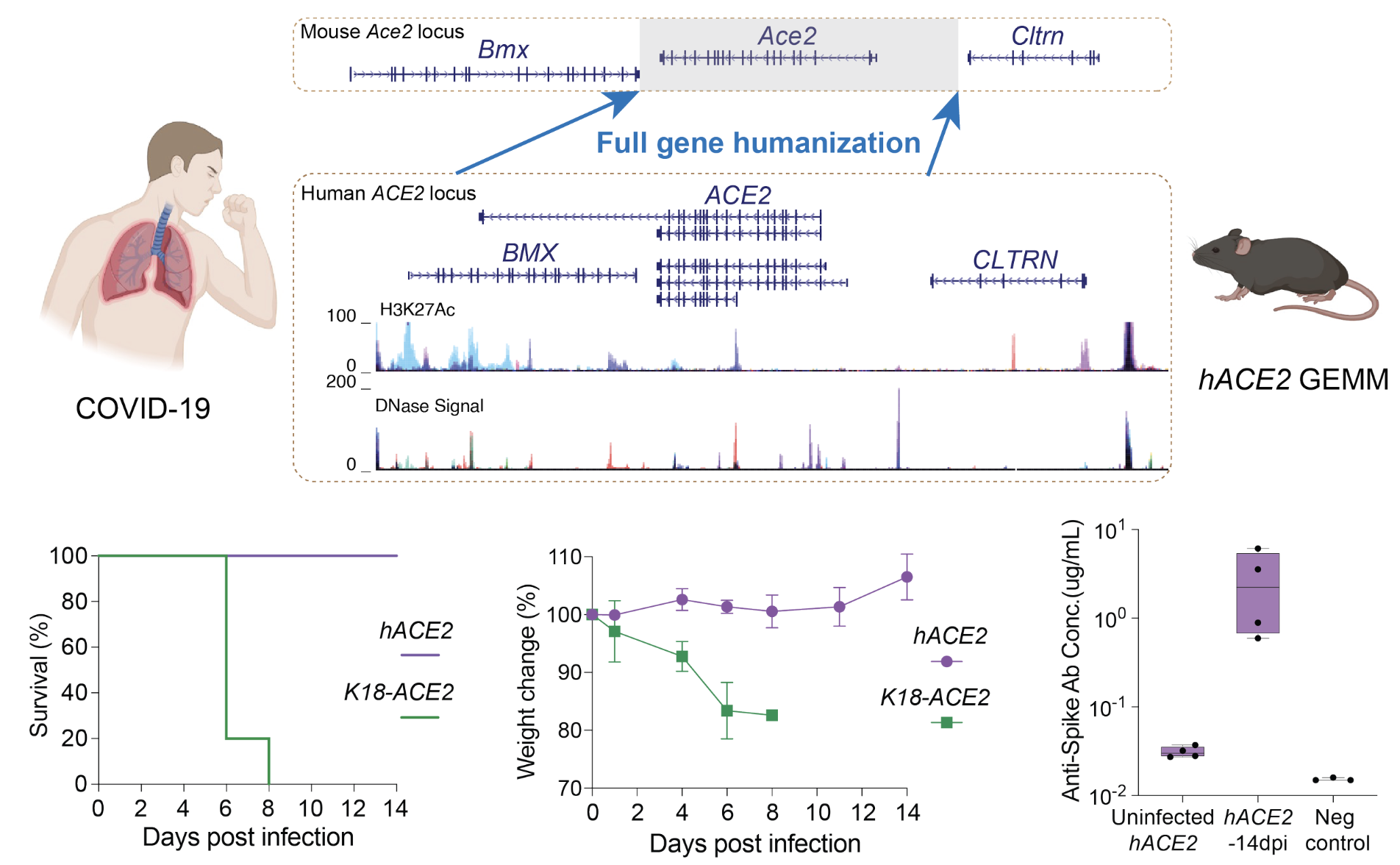
图二,ACE2全基因人源化小鼠模型的设计、构建和测试
最后,作者将大片段基因组编辑推上了一个新的高度 –在ACE2人源化的小鼠胚胎干细胞中同时对两个TMPRSS2等位基因进行编写。TMPRSS2编码细胞表面丝氨酸蛋白酶2,是介导新冠病毒入膜的另一个关键因子。在利用biallelic mSwAP-In对TMPRSS2人源化后,作者利用小鼠四倍体胚胎回补(tetraploidembryo complementation)方法培育出了ACE2, TMPRSS2双基因人源化的小鼠模型,该方法可以省略繁琐耗时的杂交过程,大大缩短了建立一个全新小鼠模型的时间。作者认为人源化ACE2受体和TMPRSS2丝氨酸蛋白酶2可以进一步提高对新冠病毒感染过程的模拟精准度,对于未来可能出现的疫情响应具有重要价值。
本文第一作者张维民于2012-2017年期间博士就读于清华大学生命科学学院,曾获清华大学研究生特等奖学金。现任职纽约大学医学院系统遗传学研究所Research Assistant Professor。博士期间在Science杂志发表封面文章报道人工合成酿酒酵母基因组编写工作。本篇Nature文章是基因组编写从单细胞真核生物向高等哺乳动物基因组编写迈进的重要一步。正如文章讨论部分中提到的,该技术不但适用于小鼠基因组人源化编写,还可应用于其他重要模式哺乳动物基因组编写,为构建多种精确的人类疾病动物模型埋下伏笔。
原文链接:https://www.nature.com/articles/s41586-023-06675-4
Nature Briefing链接:https://www.nature.com/articles/d41586-023-03079-2