


随着基因组合成技术的进步,我们现在已经可以合成原核生物(例如大肠杆菌、支原体)的基因组,甚至是合成真核生物酿酒酵母的染色体。然而,由于基因组的大小和复杂性,哺乳动物基因组合成仍然令人望而却步。
人源化小鼠模型是研究人类疾病的重要模型,然而,许多人类疾病缺乏精确的小鼠模型,这是因为在技术上很难制造广泛的遗传人源化小鼠。例如,在新冠研究中,一个重大挑战就是小鼠模型在模拟人类感染新冠后的病理生理学方面的局限性。
如果能够开发出一种更无痕、更高效的哺乳动物基因组写入(genome writing)技术,用来构建完全人源化的动物模型,这对于人类疾病的研究和药物开发帮助巨大。
2023年11月1日,纽约大学朗格尼医学中心的 Jef D. Boeke 团队(张维民博士为论文第一作者)在 Nature 期刊发表题为:Mouse genome rewriting and tailoring of three important disease loci 的研究论文。
该研究开发了一种在小鼠胚胎干细胞中大规模、高效、无痕重写基因组的方法——mSwAP-In,并展示了使用mSwAP-In迭代重写长达115kb的定制Trp53位点,以及使用人类ACE2基因替换小鼠的ACE2,从而生成人源化ACE2的小鼠模型。
值得注意的是,这一人源化ACE2小鼠模型再现了人类ACE2的表达模式和剪接方式。与现有的K18-hACE2小鼠模型相比,该模型在SARS-CoV-2病毒攻击时表现出较轻的症状,因此代表了更像人类的SARS-CoV-2动物感染模型。

基因工程小鼠疾病模型是研究人类疾病的宝贵工具,但想要在小鼠身上完全概括人类基因的复杂性是困难的。例如,如果要模拟人类COVID-19病例,就需要具有完全“人源化”ACE2的小鼠来模拟该基因的表达水平和分布模式。
目前,转基因ACE2小鼠模型已经为了解SARS、MERS和新冠病毒提供了良好的研究平台。然而,它们也存在局限性:1、缺乏人类基因组中对ACE2的调控元件,不能概括人类ACE2的时空调控;2、小鼠体内可能缺乏人类ACE2所需的剪接信号;3、转基因小鼠同时也表达内源性ACE2(鼠源),导致人和小鼠对应受体的复杂表达。
因此,迫切需要一种基因组人源化ACE2小鼠模型,来更准确地模拟新冠病毒感染。
在这项最新研究中,研究团队团队围绕着一种编辑DNA的新方法展开。区别于CRISPR基因编辑技术一次只能编辑一个或几个碱基对,这种方法选择从头开始构建DNA——在预先组装的大量基因代码中进行广泛修改,然后再递送到细胞中以代替其天然对应物。
鉴于人类基因的复杂性,研究团队首先在酵母中开发了这种“基因组写入”方法。酵母是一种单细胞真菌,与人类细胞具有许多共同特征,但更简单,更容易研究。在酵母中取得成功之后,研究团队团队将这一技术应用到哺乳动物中。
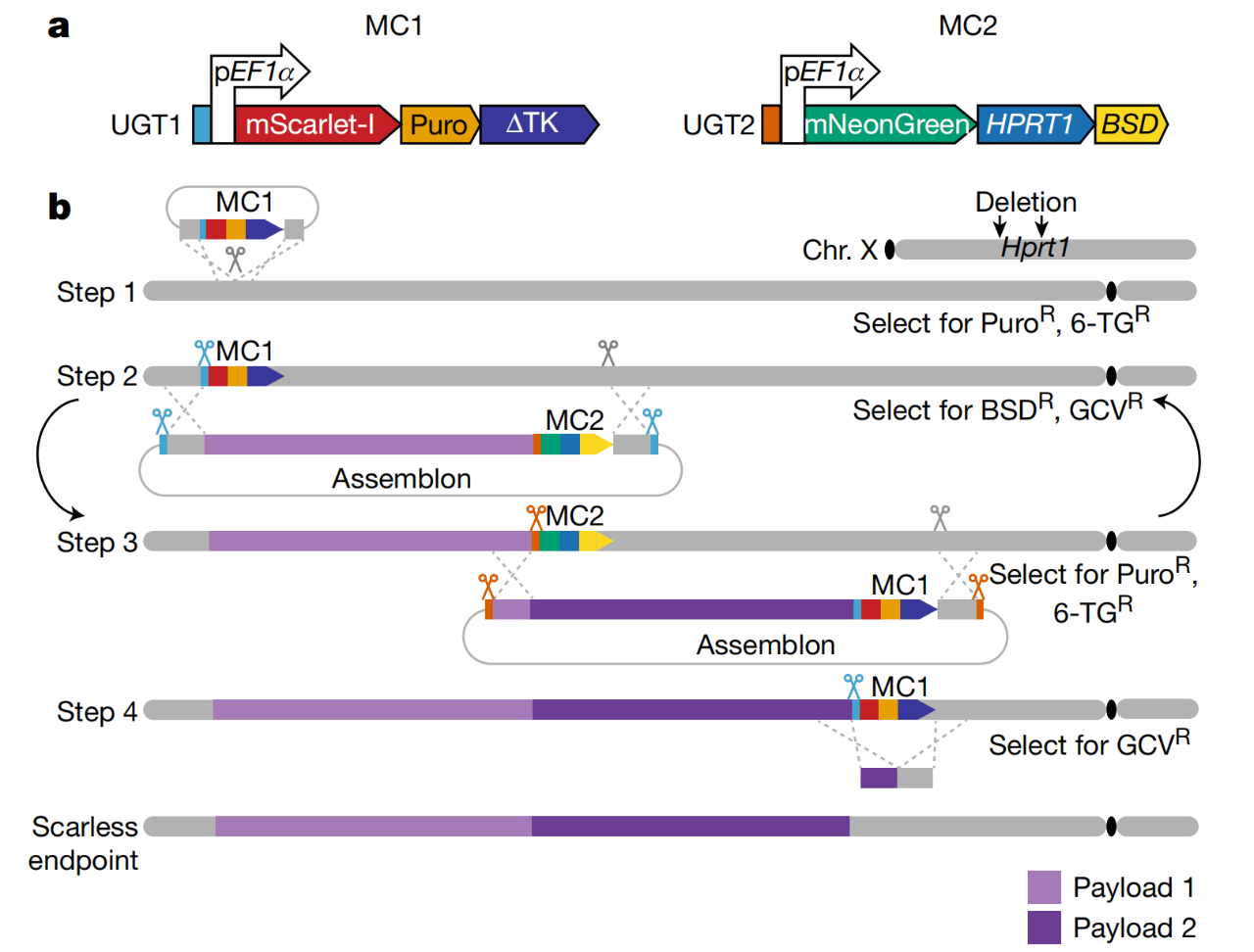
用于基因组写入的mSwAP-In策略
值得一提的是,在哺乳动物细胞中,遗传密码不仅由编码蛋白质的基因组成,还包括许多调控“开关”,这些“开关”的存在使得不同细胞类型具有极其多样化的基因表达模式,即使这些细胞具有完全相同的基因序列。
通过研究这种鲜为人知的调控基因的“暗物质”,研究团队首次能够设计出具有更接近人类ACE2基因活性水平的小鼠模型。研究团队先在酵母细胞中组装出多达20万个碱基对的DNA序列,然后使用他们的新方法——mSwAP-In将这一DNA序列递送到小鼠胚胎干细胞中。
mSwAP-In克服了过去方法的大小限制,通过用180kb的人类ACE2基因及其调控DNA“覆盖”72kb的小鼠ACE2代码,构建了人源化的COVID-19小鼠病理模型。
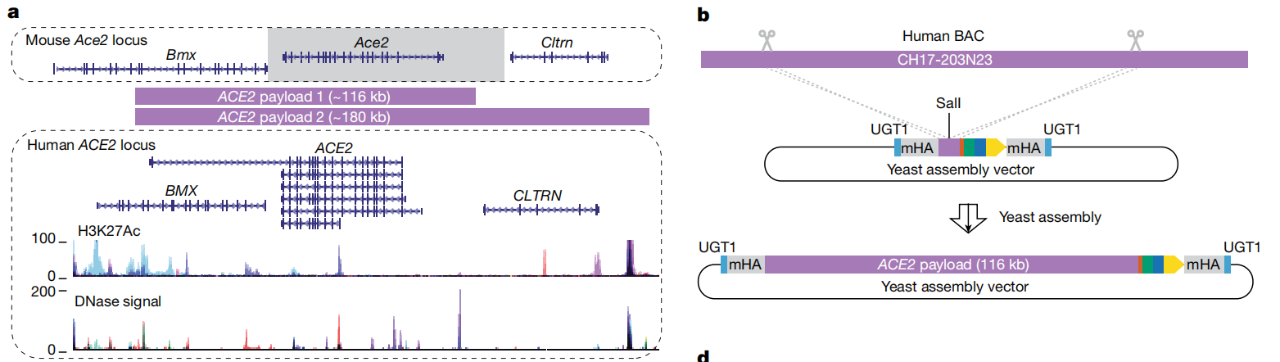
将小鼠胚胎干细胞中的ACE2完全人源化
为了完成这种跨物种交换,研究团队团队在天然基因周围的DNA代码中切下一个关键位点,分步骤交换合成的对应基因,每添加一个,增加一个质量控制机制,以便只有具有合成基因的细胞存活下来。
随后,研究团队与纽约大学啮齿动物基因组工程实验室的Sang Yong Kim合作,使用一种称为“四倍体互补”的干细胞技术来制造一只活小鼠,其细胞包含覆盖的基因,从而生成了ACE2人源化小鼠模型。
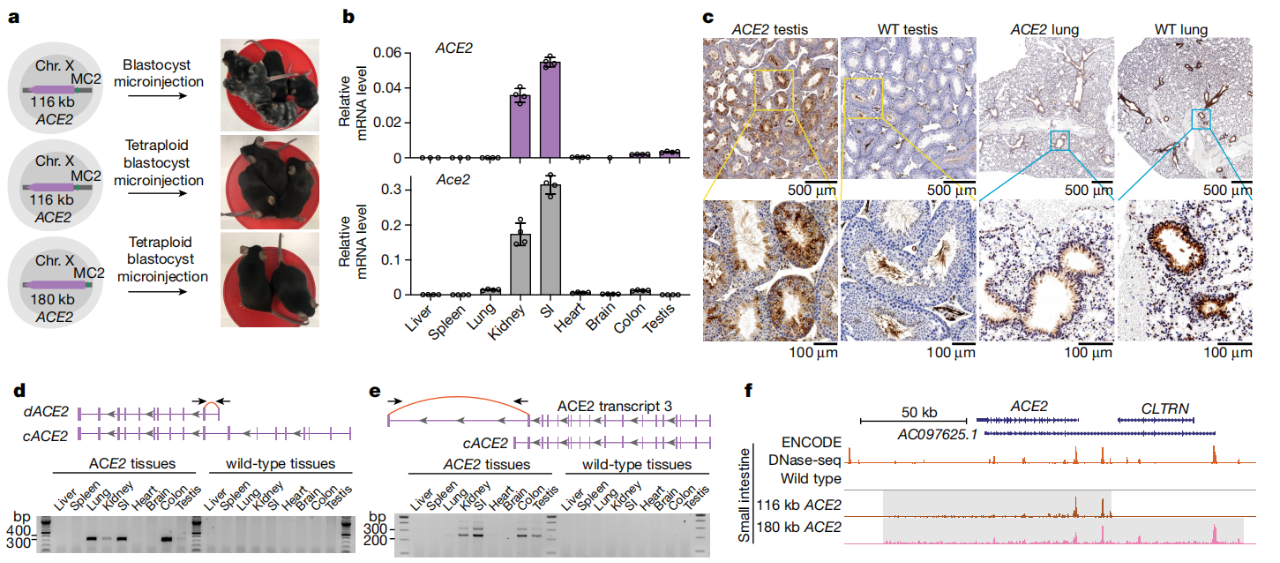
小鼠中ACE2表达的表征
进一步研究显示,该研究构建的ACE2人源化小鼠在鼻内感染时对SARS-CoV-2易感,但与K18-hACE2转基因小鼠不同,这些小鼠不会死于感染。这表明ACE2人源化小鼠是研究COVID-19更好的动物模型。
不仅如此,研究团队进一步在ACE2人源化小鼠的胚胎干细胞中用人源TMPRSS2覆盖小鼠TMPRSS2,证明了mSwAP-In的双基因的基因组写入能力,从而获得了ACE2和TMPRSS2双人源化小鼠。
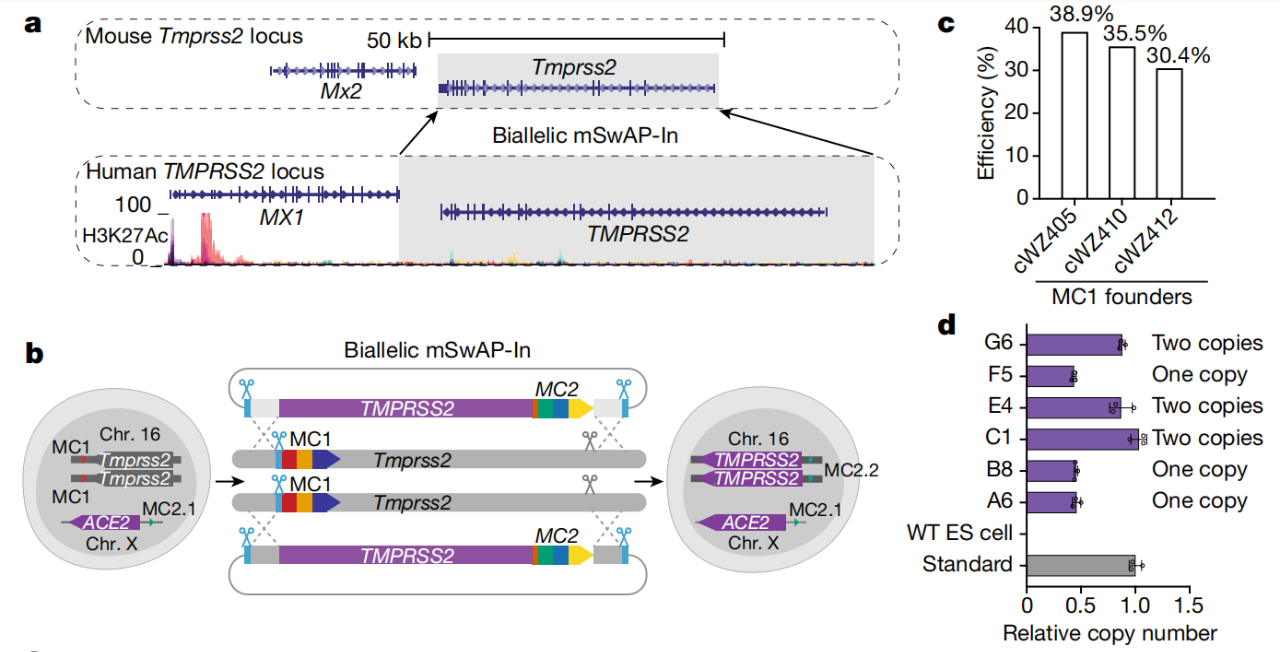
构建ACE2和TMPRSS2双人源化小鼠模型
此外,研究团队此前还设计了一种合成版本的Trp53基因(人类抑癌基因P53在小鼠中的对应基因),并将其交换到小鼠细胞中。该基因编码的蛋白质协调细胞对受损DNA的反应,甚至可以诱导细胞死亡,以防止细胞癌变。因此,当这个“基因组守护者”本身出现缺陷时,它就成了人类癌症的主要诱因。
ACE2实验中替换的是一个未改变的人类基因,而人工合成的、被替换的Trp53基因被设计成一种更稳定的形式——研究人员用包含AG的序列覆盖了关键的CG易突变位点,从而降低了Trp53基因的脆弱性,预计这种替换将使其突变率降低到原来的1/50到1/1。

论文第一作者张维民博士,张维民博士毕业于清华大学,现为纽约大学朗格尼医学中心的研究助理教授
论文第一作者张维民博士表示,团队的下一个目标是在活体动物上证明替换Trp53基因是否会导致更少的基因突变和更少的肿瘤。
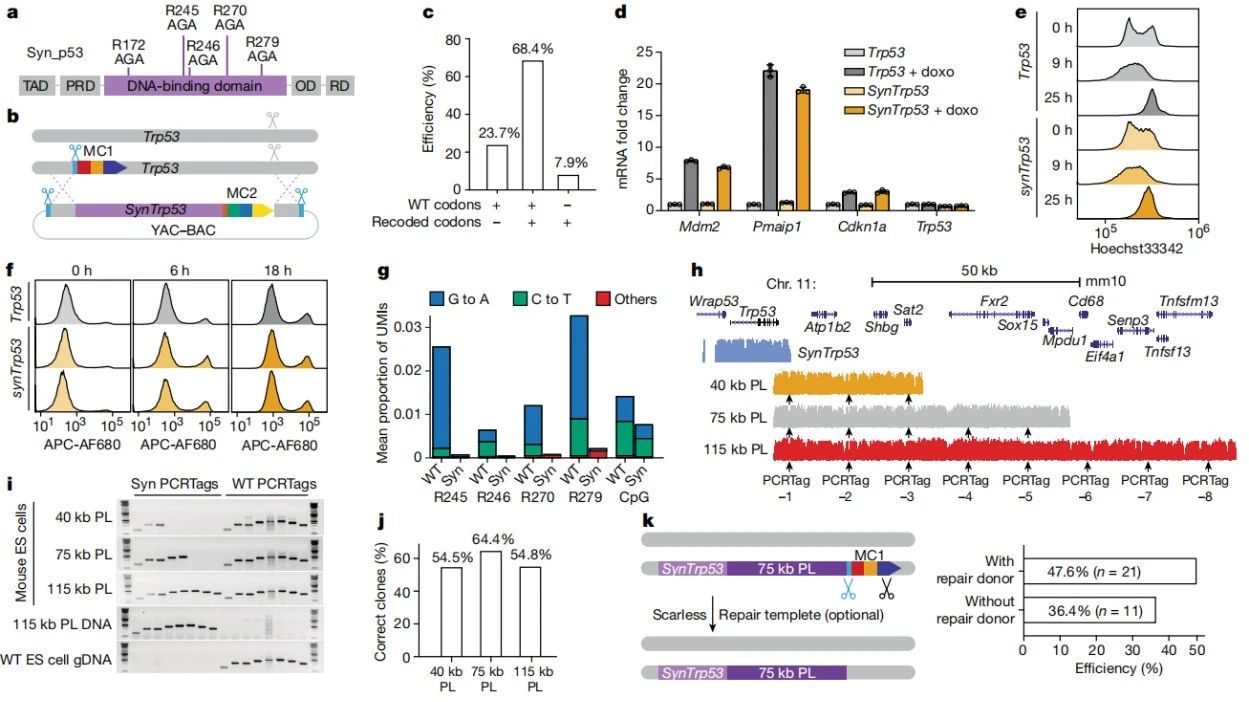
用mSwAP-In重写Trp53基因
总的来说,这项发表在 Nature 的研究开发了一种全新的DNA编辑技术——mSwAP-In,该方法可用于对小鼠中的任何基因或一组基因进行人源化,从而能够快速生产动物模型,而无需通常需要耗时的育种过程。随着DNA合成成本的下降,合成和替换更大的基因组片段、甚至重写整个小鼠染色体将成为可能,从而更方便科学研究揭秘基因组的运作模式。